|
к разделу "ХИМИЯ"
ПОДГРУППА КИСЛОРОДА
Татьяна Кузьмина,
Ульяновск astera52@mail.ru
1. Каково строение атома серы?
2. Каковы возможные степени окисления серы в соединениях?
3. Назовите важнейшие минералы серы.
4. Где в природе еще встречается сера?
5. Как получают серу в промышленности?
6. Каковы физические свойства серы?
7. Какие аллотропные формы серы вам известны?
8. В какие реакции может вступать сера?.
9. Где применяется сера?
10. Каковы физические свойства сероводорода?
11 . Как расположены атомы в молекуле сероводорода, какого типа связь между ними и каковы их степени окисления?
12. Как получают сероводород? Укажите не менее 2 способов.
13. Почему сероводород является сильным восстановителем?
14. Как происходит полное и неполное окисление сероводорода?
15. Что образуется при растворении сероводорода в воде?
16. Какие еще реакции возможно для сероводорода? У/р.
17. Как распознать сульфиды? Где они применяются?
18. Какие оксиды образует сера? Каковы степени окисления серы в них?
19. Как можно получить диоксид серы (укажите не менее 3 способов)?
20. Почему диоксид серы может быть и окислителем, и восстановителем?
21. Какие реакции возможны для диоксида серы?
22. Где применяется диоксид серы?
23. Что образуется при растворении диоксида серы в воде?
24. Что вы знаете о сернистой кислоте?
25. Как можно получить триоксид серы?
26. Что образуется при растворении триоксида серы в воде?
27. Что такое олеум?
28. Каковы физические свойства серной кислоты?
29. Как правильно растворять концентрированную серную кислоту в воде.
30. Как в промышленности получают серную кислоту?
31. Каковы химические свойства разбавленной серной кислоты?
32. Какова качественная реакция на сульфат-ион?
33. Почему концентрированная серная кислота является сильным окислителем?
34. Каковы особые свойства концентрированной серной кислоты?
35. Как такая кислота взаимодействует с металлами?
З6. Где применяются серная кислота и ее соли?
Упражнения и задачи.
1.Составьте уравнение реакции диоксида азота с серой.
2. 15 г цинка нагрели с 6,4 г серы. Какова масса полученного сульфида?
3.Бесцветный газ А с запахом тухлых яиц реагирует с бесцветным газом Б с резким характерным запахом. При реакции образуется простое вещество В и сложное. В взаимодействует с медью с образованием соли черного цвета. Определите А,Б,В, составьте уравнения реакций.
4.Почему нельзя сушить сероводород, пропуская его через концентрированную серную кислоту?
5. Сульфид железа содержит в виде примеси железо. Какая примесь присутствует в сероводороде, полученном из такого сульфида? Как ее обнаружить? Составьте уравнения реакций, опишите действия.
6.При взаимодействии сероводорода с сернистым газом образовалось 100 г серы. Какой объем сероводорода вступил в реакцию?
7.Какая соль образуется при смешении равных объемов аммиака и сероводорода? Назовите ее.
8. Разбавленная азотная кислота на холоде окисляет сероводород до свободной серы, при этом образуются монооксид азота и вода. Сколько г серы и л N О получилось, если было окислено 3,36 л сероводорода?
9.Сколько г сернистого газа можно получить из 1 т колчедана, содержащего 45% серы при выходе 98%? (0,882 т)
10.Какой объем сернистого газа выделится при обжиге 1 кг руды, содержащей 80% дисульфида железа?
11.Какая масса колчедана, содержащего 90% дисульфида железа, нужна для получения 1 м 3 диоксида серы?
12.Какой объем диоксида серы выделится, если на раствор, содержащий 25,2 г сульфита натрия, подействовать избытком соляной кислоты?
13.Сколько г сульфита натрия должно вступить в реакцию с соляной кислотой для получения 16 г сернистого газа?
14.Почему нельзя получить безводную сернистую кислоту путем выпаривания или перегонки раствора?
15. Как обнаружить присутствие в растворе сернистой кислоты, не пользуясь реактивами?
16.Составьте уравнения реакций по схемам:
а) |
FeS 2 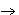 S S 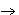 SO 2 SO 2 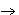 H 2 SO 4 H 2 SO 4 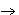 CuSO 4 CuSO 4 |
б) |
H 2 S 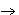 S S 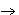 SO 2 SO 2 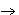 H 2 SO 3 H 2 SO 3 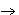 CaSO 3 CaSO 3 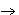 SO 2 SO 2 |
в) |
S 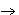 SO 2 SO 2 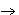 K 2 SO 3 K 2 SO 3 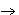 SO 2 SO 2 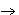 H 2 SO 4 H 2 SO 4 |
|
 |
|
NaHSO 3 |
17. Как изменяются окислительные свойства серы в ряду: сероводород, сера, сернистая кислота, серная кислота? Назовите самый сильный окислитель и самый сильный восстановитель и объясните ответ.
18. Как очистить небольшое количество азотной кислоты от примеси серной кислоты?
19. Как будет изменяться со временем масса открытого сосуда: а) с очень разбавленным раствором серной кислоты б) с концентрированной серной кислотой?
20. Склянка до краев наполнена концентрированной серной кислотой и оставлена на воздухе. Что произойдет через несколько дней? Почему?
21. Какую соль нужно добавить к раствору сульфата цинка, чтобы получить хлорид цинка без примесей?
22. Приведите пример соли, которая образует осадки и со щелочью, и с хлоридом бария.
23. Имеется смесь сульфата натрия и карбоната натрия. Какие вещества будут реагировать в водном растворе: а) с обеими солями б) с одной из них (любой)?
24.При соединении двух жидких при обычных условиях оксидов А и Б образуется вещество В, водный раствор которого обугливает сахарозу. Определите А,Б,В, напишите уравнения всех реакций.
25. Имеется водный раствор смеси нитрата бария, сульфида бария, сульфида калия. Какие реактивы нужно добавить к этому раствору, чтобы: а) выделился газ б) выпал осадок? Составьте уравнения реакций.
26. Как распознать растворы сульфита, карбоната и сульфата натрия при помощи одного реактива? Какие реакции при этом будут протекать и какие их признаки будут наблюдаться?
27. К раствору смеси карбоната калия и сульфата натрия прилили сначала избыток серной кислоты, а затем раствор хлорида бария. Какие ионы остались в растворе?
28. Бесцветный газ А с резким характерным запахом горящих спичек окисляется катализатором в соединение Б - летучую жидкость. Б, соединяясь с негашеной известью, образует В. Определите А.Б,В, составьте уравнения реакций.
29. Какую массу 80%-ного раствора серной кислоты можно получить из 1 кг железного колчедана, содержащего 60% серы?
30. К 30 г 12%-ной серной кислоты добавили 4 г триоксида серы. Вычислите массовую долю вещества в полученном растворе. (22%)
31. Сколько т безводной серной кислоты можно получить из 800 т колчедана, содержащего 45% серы? (1100 т)
32. Определите массу колчедана, содержащего 60% серы, необходимого дли получения 1 кг чистой серной кислоты.
33. Достаточно ли 30 мл 25% раствора серной кислоты (р 1,18) для взаимодействия с 5,6 г железа?
34. Из 320 т колчедана, содержащего 45% серы, получено 405 т серной кислоты. Каков выход кислоты в процентах от теоретически возможного?
35. Сплав серебра, магния и цинка массой 9 г (массы всех компонентов равны) поместили в 250 г 15% серной кислоты. Каковы массовые доли веществ в полученном растворе? (5,87% 2.91% 8,13%)
_____________________________________________
Репетиторство по электронной почте: astera52@mail.ru
|



