|
Методическая
копилка
Полифенольные антиоксиданты – тема для внеклассных занятий
Марголин Сергей Леонидович
Российский Химико-технологический Университет
В настоящее время очень остро встаёт вопрос о преподавании курса химии в средней школе. Особенно ярко это выражено на фоне популяризации гуманитарного направления. Большинство школьников скептически относятся к естественнонаучным дисциплинам, в том числе к химии. Поэтому учителям средних школ очень сложно преподносить материал.
Однако вполне очевидно, что при современных технологических, экологических проблемах сложно прожить без знания химии. Химия – наука эмпирически-экспериментальная. Сложно привлечь внимание школьников теоретической составляющей данной дисциплины. Поэтому стоит уделять особое внимание экспериментальной составляющей. Причём, при плохом финансировании общеобразовательных учреждений, а это в первую очередь – нехватка реактивов, очень сложно организовать практические работы. Поэтому нужно искать компромисс. Излагать устно практические работы неэффективно, потому что это не является наглядным.
Существует другой подход. А именно: связать курс химии с жизнью (окружающим миром). Причём основываться нужно на наблюдениях самих школьников, которые они могут сделать, идя в школы, покупая продукты питания, просматривая новости и т.д.
В последние время общественность и СМИ уделяют большое внимание состоянию окружающей среды, качеству продуктов питания, всевозможным пищевым добавкам и т.д.
Очень часто по телевидению, по радио, и в прессе встречается реклама пищевых добавок на основе антиоксидантов. Известно, что школьники тратят очень много времени на просмотр телевидения, Интернета, слушают радио, поэтому, можно утверждать, что c такого рода рекламой они сталкивались. Данная работа посвящена действию антиоксидантов. А поскольку большинство природных антиоксидантов являются представителями фенолов, то целесообразно провести урок на тему «Антиоксиданты и их влияние на организм человека» после раскрытия темы «Фенол и его гомологии, полифенолы».
Прежде чем преступить к обзору материала, посвященного антиоксидантам, стоит рассмотреть формат занятий, на которых можно использовать приём, описанный в введении.
Для начала нужно отметить главную проблему, которая стоит перед любым учителем. Это, конечно же, время. Поэтому для повышения интереса школьников к предмету, учитель должен создать факультатив и заинтересовать школьников, чтобы они его посещали.
Учителям-химикам это сделать крайне трудно, т.к., как уже отмечалось выше, заинтерованность учеников химией крайне мала. Но, тем не менее, – это возможно. Например: факультативное занятие можно разбить на две части, в первой части учитель разбирает то, что было на основном уроке, а затем плавно переходит ко второй части ? дополнительному материалу. При этом во время повторения основного урока, преподаватель может разбирать похожие задание, которые входят либо в домашнее задание, либо в контрольную работу. В таком случае у ученика будет стимул ходить на факультатив. Далее всё зависит от умения учителя. Он должен «удержать» и заинтересовать учеников.
Возможен и другой вариант: на одном из основных уроках учитель делает презентацию своего факультатива. Презентация должна быть проведена таким образом, чтобы заинтересовать учеников. Этого можно достигнуть, например: постановкой проблемных ситуаций, показом обучающего фильма, проведение лекции с использованием современных технический средств обучения (кадоскоп, мультимедийный проектор и т.д.) посещением музеев и пр.
Организованная внеклассная работа может состоять из отдельных компонентов. Здесь нет ограничений, нет жестко регламентированных программ. Тематика может быть разнообразной. Стоит помнить, что во внеклассной работе больше, чем в любой другой, проявляется влияние личности учителя, его кругозора, интересов, теоретического и нравственного багажа. Преподаватель должен быть готовым к любым вопросам, которые ему могут задать ученики. Тем не менее, содержание внеклассной работы по химии подчиняется строго определённым требованиям [4]:
• Научность. Этот дидактический принцип – важное условие успеха внеклассной работы.
• Доступность. Содержание должно соответствовать возрастным особенностям учащихся. Не стоит уходить от школьной программы. Если это неизбежно, то теоретические выкладки нужно давать в упрощенном, понятным для школьников виде. Нужно стимулировать стремление к познанию, к работе с дополнительной литературой, к исследовательской деятельности.
• Актуальность и практическая значимость, связь с жизнью.
• Занимательность. При всей серьёзности затрагиваемых проблем внеклассная работа должна быть занимательной, содержать новые для учащихся интересные факты, неожиданные сопоставления. Необходимо использовать научную фантастику, разрабатывать творческие задания, прибегать к диспуту, использовать проблемный метод обучения и т.д.
Все реакции включают в себя разрыв старых и создание новых связей. Способ разрыва связи имеет очень важное значение от того, как проходит реакция. Можно выделить два вида разрыва связи [ 7 ] :
• гетеролитический разрыв . В этом случае, когда связь разрывается, оба поделенных электрона переходят только к одному атому. Этот атом становится отрицательно заряженным, потому что у него получается на один электрон больше, чем протонов. Другой атом приобретает положительный заряд. Такие частицы называются ионами.
• - гомолитические разрыв . В этом при разрыве одной связи к каждому атому отходит по одному электрону. Следовательно, у образовавшихся частиц есть по одному неспаренному электрону. Общий электрический заряд таких частиц нулевой. А неспаренный электрон имеет сильную тенденцию к спариванию с другим электроном из другого атома. Этим объясняется высокая реакционная способность данных частиц, название которых – радикалы.
У некоторых радикалов может быть больше, чем один неспаренный радикал, например: атом кислорода О имеет два неспаренных электрона и является двойным радикалом или бирадикалом.
Окислительная способность атмосферного воздуха не вызывает сомнений и подтверждается термодинамическими расчётами. Долгие годы протекание процессов окисления в тропосфере связывали с присутствием в ней озона, кислорода и перекиси водорода. Однако, как показали исследования последних десятилетий, основную роль в процессах окисления в газовой фазе играют свободные радикалы. Имея по одному (или несколько) неспаренному электрону на внешней электронной орбите, свободные радикалы являются сильными окислителями и принимают самок активное участие в процессах окисления примесей в газовой фазе тропосферы. Среди свободных радикалов, обнаруженных в атмосфере, прежде всего, следует выделить гидроксидный радикал, который может образоваться в результате фотодиссоциации воды. Примеры радикалов и соединений, которые являются источниками, приведены в табл. 1. [ 6 ]
Таблица 1
| Акцептор |
Соединения радикальные |
Соединения нерадикальные |
| Кислород |
Супероксид O 2 -- Гидроксил OH• Пероксил RO 2 • Алкоксил RO• |
Перекись водорода H 2 O 2 Гипохлорная кислота HOCl Гипобромная кислота HOBr Озон O 3 Синглетный кислород |
| Азот |
Гидропероксил HO 2 • Монооксид азота NO•
Диоксид азота NO 2 •
|
Азотистая кислота HNO 2 Нитрозильный катион NO+ Нитроксильный анион NO- Тетроксид диазота N 2 O 4 Триоксид диазота N 2 O 3 Пероксинитрит ONOO- Нитрилкатион NO 2 + Алкил пероксинитриты ROONO |
| Хлор |
Атомный хлор Cl• |
Гипохлорная кислота HOCl Хлор Cl 2 Нитрил хлорида NO 2 Cl Фреоны |
На рисунке 1 приведены органы-мишени свободных радикалов и болезни, которые развиваются под действием избытка радикалов. Негативное действие свободных радикалов проявляется в ускорении старения организма, провоцировании воспалительных процессов в мышечных, соединительных и других тканях, неправильном функционировании различных систем организма: циркуляционной, нервной (включая клетки мозга) и иммунной систем. Эти нарушения связаны, прежде всего, с повреждением клеточных мембран.
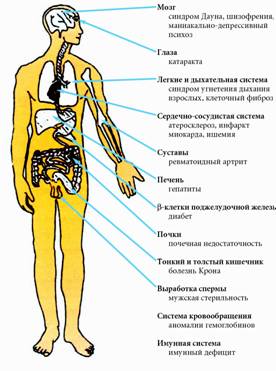
|
Рисунок 1 |
В научной литературе этот процесс называется "пероксидное окисление липидов", а результат разрушительного воздействия - оксидативный стресс. Свободные радикалы могут также проявлять мутагенные свойства, связанные с нарушением структуры молекул ДНК и рибосомной РНК, вызывая изменения наследственной информации и раковые заболевания.
Обычно здоровый организм сам справляется со свободными радикалами, возникающими в процессе естественного метаболизма клеток, однако неблагоприятные внешние факторы приводят к ситуации, когда защитные силы организма уже не в состоянии нейтрализовать избыток агрессивных частиц, причем риск многократно повышается при физических и эмоциональных нагрузках.
В процессе эволюции природа создала защиту против разрушительного действия свободных радикалов. Эти вещества - антиоксиданты. [6]
В биологических системах антиоксидантами называются вещества, способные ингибировать процессы свободнорадикального окисления. Для живых клеток наибольшую опасность представляет цепное окисление полиненасыщенных жирных кислот, или перекисное окисление липидов (ПОЛ). В реакциях ПОЛ образуется большое количество липидных гидроперекисей, которые обладают высокой реакционной способностью и оказывают мощное повреждающее действие на клетку.
Защита организма от этих и многих других заболеваний - основная задача антиоксидантной системы. Антиоксиданты предотвращают перекисное окисление липидов и не дают свободным радикалам накапливаться в организме. Однако естественная антиоксидантная система организма часто оказывается перегруженной и буквально захлебывается лавиной свободных радикалов. Это состояние называется окислительным стрессом. Чаще всего окислительный стресс вызывается УФ излучением, которое не только индуцирует свободнорадикальное окисление, но и нарушает работу ферментных антиоксидантов кожи.
По механизму действия10 антиоксиданты можно разделить на:
• "мусорщиков" (scavenger of free radicals), которые очищают организм от всех свободных радикалов, чаще всего, восстанавливая их до стабильных неактивных продуктов;
• "ловушки" (trap of free radicals) - антиоксиданты, которые имеют сродство к какому-то определенному свободнорадикальному продукту (ловушки синглетного кислорода, гидроксил-радикала и т.д.). Ловушки часто используют для уточнения механизма свободнорадикальной реакции;
• антиоксиданты, обрывающие цепи (chain breaking antioxidants) - вещества, молекулы которых более реакционноспособны, чем их радикалы. Чаще всего это фенолы, которые легко отдают свои электроны, превращая радикал, с которым они прореагировали, в молекулярный продукт. А сами при этом превращаются в слабый феноксил-радикал, который уже не способен участвовать в продолжение цепной реакции.
Антиокислительная система тканей представлена:
• ферментными антиоксидантами: супероксиддисмутазой, каталазой, пероксидазами, глутатионредуктазой и восстановленным глутатионом;
• макромолекулярными неферментативными компонентами: белком-переносчиком железа ? трансферрином и другими белками сыворотки, способными связывать ионы железа ? церулоплазмином, гаптоглобинами, гемопексином;
• низкомолекулярными компонентами: женскими половыми гормонами, тироксином, флавоноидами, стероидными гормонами, витаминами А, Е, К, убихиноном, низкомолекулярными SH-соединениями и аскорбиновой кислотой.
Полифенольные антиоксиданты
Классификация фенолов
Широте распространения фенольных соединений в растительном мире соответствует и разнообразие их химической структуры. Разобраться в этой массе веществ непросто. Нужно опираться при этом на определённые закономерности. Прежде всего, фенольные вещества встречаются в растениях, подобно углеводам, белкам, нуклеиновым кислотам, в виде моно- и полимерных соединений. Основной их структуры является углеродный скелет, в строение которого число и расположение гидроксильных групп, а также других группировок и углеводородных радикалов вносят достаточное разнообразие. Соединения фенолов с углеводами образуют обширный класс гликозидов, фенольная часть которых носит название агликона.
Мономерные фенольные соединения. Это простейшие представители фенольных мономеров имеют совершенно одинаковый шестичленный углеродный скелет – бензольное ядро и никаких боковых цепочек. В растениях эти вещества в свободном состоянии встречаются крайне редко. Так, фенол содержится в иглах и шишках сосны, в некоторых лишайниках, пирокатехин – в чешуе лука, плодах грейпфрута, флороглюцин – в шишках секвойи. Гидрохинон несколько более распространён: его довольно много, главным образом в виде глюкозида арбутина, в листьях, коре и семечках груши. Гораздо шире распространены сложные олиго- и полимерные фенолы, в состав которых входят остатки пирогаллола, пирокатехина, и флороглюцина.
Оксибензойные кислоты. Это соединения, у которых короткая боковая цепочка представлена карбоксильной кислотной группой – СООН. Простейшие соединения этого ряда – бензойная кислота гидроксильных групп и поэтому к фенольным соединениям не относится. По взаимному расположению карбоксильной группы и гидроксильной групп фенокислоты делятся на две основные группы (см. рисунок 3).
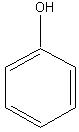
Фенол |
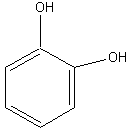
Пирокатехин |
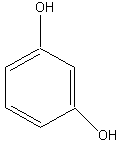
Резорцин |
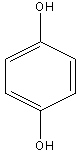
Гидрохинон |
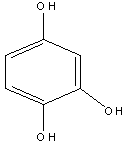
Оксигидрохинон |
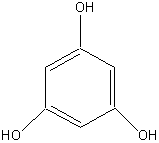
Флороглюцин |
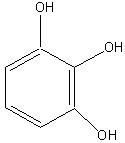
Пирогаллол |
Рисунок 2. Основные представители мономерных фенольных соединений |
Эти вещества распространены достаточно широко у покрытосеменных растений в свободном виде, а п -оксибензойная, ванилиновая и сиреневая кислоты образуются при деструкции лигнина. Димеры галловой кислоты встречаются в свободном состоянии, так и в виде полимерных гало- и эллаготаннинов.

|

|
Салициловая кислота (1,2 - Н)
о -Пирокатехиновая (1 – ОН, 2 - Н)
Гентизиновая (1 – Н, 2 – ОН) |
п -Оксибензойная (1, 2 – Н)
Протокатеховая (1 – ОН, 2 - Н)
Галловая (1, 2 - ОН)
Ванилиновая (1 – ОСН 3 , 2 – Н)
Сиреневая (1, 2 – ОСН 3 ) |
Рисунок 3 Представители оксибензольных кислот. |
Следующих класс полифенолов относятся к ряду оксикоричных кислот и кумаринов распространены в растительном мире. Сама коричная кислота фенольным соединением не является ввиду отсутствия в её молекуле гидроксила в бензольном ядре. Среди её многочисленных оксипроизводных наиболее распространены четыре кислоты, которые приводятся на рисунке 4.

|
п -Кумаровая (1, 2 ? Н)
Кофейная (1 – ОН, 2 – Н)
Феруловая (1 – ОСН 3 , 2 – Н)
Синаповая (1, 2 – ОСН 3 )
Рисунок 4 Представители оксикоричнового ряда |
У кумаринов трехуглеродная боковая цепь через атом кислорода замыкается в дополнительный шестичленный гетероцикл, сопряженный с основным (см. рисунок 5).
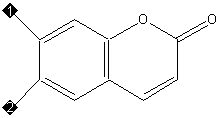 |
Кумарин (1, 2 – Н)
Умбеллиферон (1 – Н, 2 – ОН)
Эскулетин (1, 2 – ОН)
Скополетин (1 – ОСН 3 , 2 – ОН)
Рисунок 5. Представители ряда кумарина |
Сам кумарин, как и другие исходные представители рядов фенольных соединений, строго говоря, к последним не относится ввиду отсутствия фенольной гидроксильной группы. Но традиционно его относят к полифенолам. Кумарин – летучий компонент многих растений, с запахом свежескошенного сена (именно он придаёт сену такой запах). Умбеллиферон встречается в растениях семейства зонтичных. Эскулетин содержится в околоплодниках конского каштана в виде глюкозида эскулина, скополетин – в корнях скополии японской.
Одна из самых обширных групп полифенолов – это флавоноиды. Её представители встречаются в тканях практически каждого вида растений. В состав молекулы флавоноидов входят два бензольных кольца, соединенные между собой трёхулеродным мостиком. В большинстве случаев этот мостик образует (с участием атома кислорода) гетероцикл.
Рисунок 6. Общий вид флавоноидов |
Многочисленное семейство флавоноидов делится на десять структурных групп в зависимости от строения трёхуглеродного мостика и степени его окисления.
Рассмотрим наиболее часто встречающиеся в быту группы флавоноидов:
Катехины содержаться в плодах многих съедобных растений (яблоки, груши, айва, абрикосы), в ягодах (земляника, малина, брусника), а также в коре и древесине дыба, ивы, сосны, акации и других деревьев. Особенно много катехинов в молодых побегах чая, бобах какао и кола. Окислительные превращения катехинов играют важнейшую роль в производстве чая, вин, при переработке бобов какао и т. п. Они легко окисляются при нагревании, освещении лучами солнца, особенно в щелочной среде при действии окислительных ферментов. Потемнение плодов и овощей при механической и термической обработке обусловлено окислением катехинов.
Также наиболее часто встречаются антоцианиды – основные пигменты цветков, плодов, ягод, листьев, о чём говорит само их название ( antos – по-гречески цветок, kyoanos – синий). Но окраска, создаваемая этими веществами, различная - от розового до фиолетового цвета. Антоцианиды имеют положительный заряд. Поэтому в растениях они присутствуют виде солей соответствующих кислот.
Разнообразие окраски цветов зависит от числа гидроксильных групп в молекуле – с их увеличением окраска сдвигается в направлении синего цвета (дельфинидин – содержится в цветках дельфиниумах); при метилировании гидроксилов – красного (мальвидин). Кроме того, имеет значение образование комплексов антоцианов с металлами: ионы магния и кальция способствуют проявлению синей окраски, а соли калия – пурпурной.
Окисление алифатических и алкилароматических углеводородов молекулярным кислородом в жидкой фазе представляет собой радикальный цепной процесс с квадратичным обрывом цепи. Это же относится ко многим другим органическим соединениям, например: липидам. Первичным молекулярным продуктом окисления при не слишком высокой температуре являются перекисные соединения, обычно гидроперекиси, но в некоторых случаях полиперекиси или Н 2 О 2 . Детали механизма меняются в зависимости от структуры окисляемого субстрата, а также условий окисления. Продукты более глубокого окисления – карбонильные, карбоксильные и другие соединения – образуются в основном в результате последующих превращений перекисных соединений.
Наибольшее практическое значение имеет гидроперекисный механизм окисления, начальная стадия которого при достаточно больших давлениях О 2 может быть описана следующей принципиальной схемой:
схема 1. Схема неингибированного окисления |
Процессы первичной генерации радикалов (стадия зарождения цепи) весьма разнообразны. В естественных условиях радикалы образуются при взаимодействии О 2 с молекулами основного вещества или более легко окисляемой примеси, при гомолитическом распаде примесных молекул, в результате реакций с участием соединений металлов переменной валентности, присутствующих в следовых концентрациях. Радикалы могут зарождаться также при действии естественного света, ионизирующего излучения, в реакциях с участием озона и синглетного кислорода.
Взаимодействие с перекисным радикалом окисляющегося субстрата – принципиальная реакция, которая, прежде всего, определяет способность фенольных соединений тормозить цепное окисление. Продуктом реакции является феноксильный радикал:

Установлено, что радикал, образующийся приокислении фенолят-иона, претерпевает димеризацию с образованием связей углерод-углерод или углерод-кислород, но не кислород-кислород [5]
схема 2. Механизм ингибированного окисления |
Изучение переходного состояния, возикающего при подобной окислиельной димеризации фенолятов, показало, что оно имеет сэндвическую структуру из двух феноксильных радикалов.
Введение объемистых заместителей в бензольное ядро фенола делает невозможным образование сэндвического переходного состояния. Если же такие заместители в положении 2, 4, 6, то кроме того будут блокированными все свободнорадикальные центры – атом кислорода, а также орто и пара-положения. Подобные радикалы оказываются устойчивыми. Например: радикал, полученный из 2, 4, 6- три(трет-бутил) фенола, в отсутствии воздуха и активных химических реагентов может существовать неопределённо долго.
Под антиокислительной активностью (АОА) подразумевают способность антиоксидантов тормозить цепное окисление органических веществ в реальных условиях их эксплуатации, хранения и т.д. Количественной мерой АОА является длительность и глубина торможения. АОА характеризуется набором параметров – периодом индукции, скоростью окислительных процессов в периоде индукции и некоторыми другими. Таким образом, АОА не эквивалентна реакционной способности антиоксиданта по отношению к перекисным радикалам или к каким-либо другим веществам. АОА характеризует не сколько антиоксидант, а сколько систему антиоксидант-окисляемый субстрат, она зависит от условий окислений, прежде всего от температуры, начальной концентрации антиоксиданта, а также давления кислорода, геометрии окисляющегося образца, режима проведения процесса и т.п. На сегодняшней день не существует какой-либо единой шкалы АОА. Практика показывает, что положение данного антиоксиданта в ряду АОА может существенно изменяться в зависимости от природы окисляемого субстрата, условий окислений и от того, какой параметр АОА интересует в каждом конкретном случае.
Основным источником флавоноидов служат растительные продукты. Препараты растительных фенольных соединений успешно применяются в качестве средств профилактики атеросклероза, антигипоксантов, антиаллергических средств, они снижают токсические эффекты противотуберкулезных препаратов и тетрациклиновых антибиотиков. Эти препараты применяют при лечении лучевых поражений.
Специалисты Корнельского университета в Нью-Йорке проводили исследования уровня антиоксидантов в разных напитках, таких как чай, красное вино и какао. Антиоксиданты - вещества, помогающие предотвратить многие заболевания. Они предотвращают развитие свободных радикалов (вредных веществ, приводящих к возникновению онкологических заболеваний) и замедляют старение организма. Больше всего антиоксидантов оказалось в какао - вдвое больше, чем в красном вине и почти в три раза больше, чем в зеленом чае.
Чашка какао в день поможет сохранить здоровье. К таким выводам пришли американские ученые, выяснившие, что какао содержит большое количество мощных антиоксидантов. В последнее время многие исследования подтверждают пользу употребления чая, красного вина и какао. Все эти продукты богаты полифенолами, обладающими свойствами антиоксидантов. Они уничтожают свободные радикалы - заряженные частицы, приносящие вред клеткам и способствующие развитию онкологических заболеваний.
Проведенные в прошлом году в Китае исследования говорят о том, что любители чая вдвое меньше подвержены риску заболеть раком, чем те, кто не пьет этот напиток. Во Франции также в прошлом году ученые подтвердили существовавшую ранее теорию о том, что бокал красного вина в день вдвое сокращает вероятность инфаркта.
В 1998 году исследование, в котором участвовали восемь тысяч американцев, выявило, что употребление шоколада, который вырабатывается из какао, продлевает жизнь. Ученые доказали, что хотя какао и присутствует во многих продуктах, например в шоколаде, его лучше пить.
Ведь в шоколадных плитках много насыщенных жиров. Например, в плитке весом 40 граммов ? восемь граммов жиров, а в кружке какао - только 0,3 грамма.
«Несмотря на то, что антиоксиданты важны для сохранения здоровья, мы пока не можем сказать сколько их нужно принимать в день», - говорит ученый Чан Юн Ли из Корнельского университета.
«Тем не менее, выпиваемая время от времени чашка-другая горячего какао дает возможность получать больше антиоксидантов», - добавил он.
Продление жизни с помощью какао - это, конечно, еще не доказанный факт, но американские ученые могут сказать одно - употребление какао весомо снижает риск возникновения злокачественных опухолей.
Также доказано, что полифенольные антиоксиданты содержаться в хмельных шишках (пиво), в плодах голубики и т.д.
В данной работе собран небольшой литературный обзор по теме «полифенольные антиоксиданты». Школьный учитель может использовать данный материал на своих внеклассных занятиях.
Материал изложен только для учителя, т.к. он не рассчитан на учеников средней школы. Потому что он изложен довольно-таки глубоко. Однако, школьный учитель, базируясь на особенности своего класса, может создать увлекательный цикл занятий по предложенной теме.
В конце данной работы хотелось бы подчеркнуть необходимости проведения такого типа дополнительных занятий в средней школе, особенно для школьников гуманитарных направлений (хотя это очень трудно). Потому что такие школьники могут никогда и не узнать, например, о том, что полиэтилен на садовых участках нельзя закапывать в землю, а стоит утилизировать особым образом.
Дело в том, что современная школьная программа, а значит и учебники, не могут обхватить абсолютно всё, а тем современные исследования в области экологии, химии, биохимии и физиологии человека. А ведь это очень важные вопросы, потому что, попав во «взрослый мир», они постоянно будут сталкиваться со всевозможными вопросами, разъяснение которых может дать только химия. Школьники могут не знать фундаментальных предпосылок к таким вопросам, но им необходимо показать и рассказать те факты, которые помогли бы им сохранить своё здоровьё как можно дольше.
В заключении, также хотелось повторить основное требование к внеклассным занятиям по химии – они должны отвечать принципу политехнизма, т.е. показывать современные взгляды науки и «соприкасаться с житейскими вопросами».
- • Барабой В.А. Растительные фенолы и здоровье человека. М.: «Наука», 1984
- • Захарова Н. А., Богданов Г. Н., Заприметов Н. А. и др. ЖОХ, т. 42, 1414-1420 (1970)
- • Рогинский В. А. Фенольные антиоксиданты. М.: «Наука», 1988
- • Чернобельская Г. М. Методика обучения химии в средней школе. Гуманит. изд. центр ВЛАДОС, 2000
- • Шабаров Ю. С. Органическая химия. М.: «Химия», 2000
- • Свободно радикальное окисление и антиоксидантная защита при сахарном диабете. Под ред. И. И. Дедова. Москва, 2003
- • Химия и жизнь (Солтерская химия) Часть I . Понятия химии. Под ред. П. Д. Саркисова. М.: РХТУ, 1997
- • Vedernikova I., Tollenaere J. P., Haemers A. J. Phys. Org. Chem. 12, 144-150 (1999)
- • Чугасова В. Антиоксиданты природные и синтезированные. Лекции в электроном виде с Интернет-сайта www.cmjournal.ru
*) В данной работе понятия «факультатив», «школьный кружок» и «внеклассная работа» являются синонимы, т.е. никаких различий между ними в контексте данной работы не существует. этот пункт подробно обсуждался в Введении.
С Интернет-сайта www . gzt . ru от 14 ноября 2003 года.
|



